透過鄰近標記策略揭示核酸-蛋白質交互作用:探索 G4PID 探針和 PLGPB 策略
本文介紹了一項創新研究,作者介紹了一種名為 G4PID 的新型雙功能探針。此探針將 RHAU 的 G4 結合域 (RHAU23) 與 miniTurbo 生物素連接酶結合在一起,能夠精確靶向 G 四鏈體 (G4) 並標記活細胞內的 G4 相互作用蛋白。 G4 結構由富含鳥嘌呤的核酸序列形成,在各種細胞過程中至關重要,包括基因調控、DNA 複製和修復。儘管人們廣泛認識到 G4 的重要性,但細胞內的具體機制及其與蛋白質的相互作用仍然很大程度上未被探索。作者利用 G4PID,開發了一種專門的生物素標記方法 (PLGPB),以準確識別和分析 G4 相互作用蛋白,揭示 G4 結構在細胞功能中的關鍵作用。此方法成功鑑定了 149 個與 G4 相互作用的候選蛋白,主要參與轉錄調控、mRNA 剪接和染色質重塑。對七種候選蛋白的驗證揭示了它們對 RNA G4 結合的偏好,儘管對 DNA G4 的親和力不同。對剪接因子 SF3B4 的詳細檢查證明了它與 G4 結構的相互作用,影響選擇性剪接事件。 G4 結構的穩定改變了 SF3B4 的結合效率並影響特定基因(例如 INPPL1 和 PPP6R2)的選擇性剪接。

小檁鹼是一種傳統的生物鹼,具有抗發炎、降血糖、保護心血管等廣泛的藥理作用,引起了人們的廣泛關注。然而,其精確的分子機制,特別是在發炎抑制方面,仍不清楚。
本研究利用 ABPP 技術填補了這項知識空白,將 EIF2AK2 識別為小檁鹼發揮抗發炎作用的關鍵標靶。這項研究結果加深了我們對小檜鹼作用機制的認識,為重新定位小檜鹼和開發新型針對EIF2AK2的抗發炎藥物提供了科學依據。
團隊採用先進的化學蛋白質體學方法系統地研究小檜鹼與細胞內蛋白質的相互作用,確認其與 EIF2AK2 的特異性結合及其酶活性的調節。這會影響發炎反應途徑,有效抑制發炎進展。這項重大突破提供了對小蘗鹼抗發炎機制的深入了解,並支持針對 EIF2AK2 的新型療法的開發。
ChomiX 提供 ABPP 和 CETSA 等尖端服務,幫助研究人員探索藥物機制並加快新藥開發工作。
研究路線

實驗過程
1. G4PID 探針的建構和特異性驗證。
作者最初設計了 G4PID 探針,其中 G4 結合域 RHAU23 位於 N 端,miniTurbo 位於 C 端,透過柔性接頭連接。使用BL21 (DE3)菌株進行表現和純化。使用純化的 G4PID 進行的特異性結合驗證實驗揭示了其與 BCL2 G4 的精確結合,顯示出 15 ± 7 nM 的 Kd 值,同時對其他非 G4 結構顯示出可忽略不計的親和力。此外,作者評估了 G4PID 的生物素化特異性,證明了其選擇性生物素化 G4 相互作用蛋白的能力。
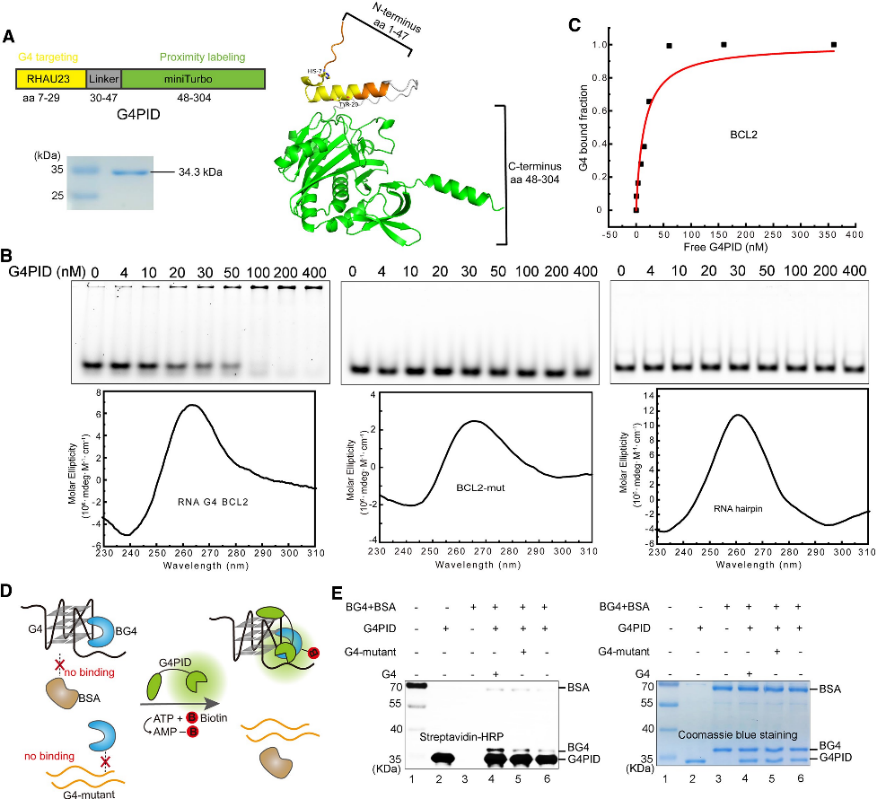
圖1 G4 PID介導G 4相互作用蛋白的特異性生物素化
2. G4PID在細胞中的RNA G4結合能力和生物素標記特徵。
作者建立了 HA-G4PID 和 HA-miniTurbo HeLa 細胞系,透過 eCLIP 實驗研究 G4PID 與細胞內 RNA G4 的結合親和力。結果證明 G4PID 與 RNA G4 選擇性相互作用,與隨機序列相比,對含有 PQS 的 RNA 序列表現出明顯更高的結合親和力。此外,作者觀察到 G4PID 的獨特特徵有助於在細胞內啟動生物素標記,而無需輔因子。這導致蛋白質標記效率顯著提高,在 30 分鐘內檢測到 G4PID 的明顯生物素化訊號,表明與 miniTurbo 相比,標記動力學更快。
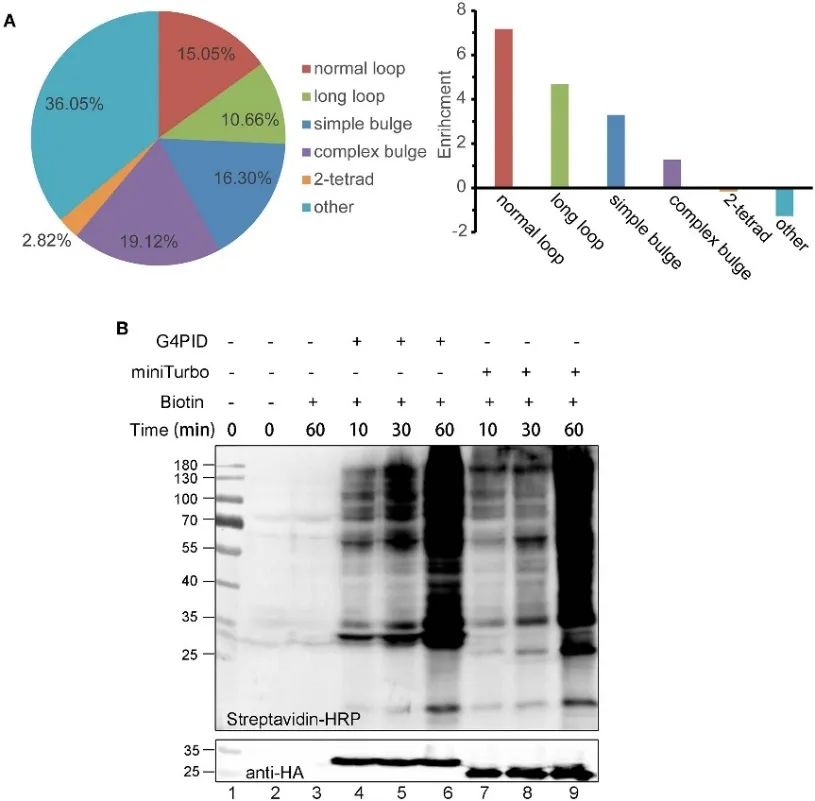
圖2 G 4 PID結合RNA G4實驗並優化HEK293T細胞中的標記效率。
3. 使用 PLGPB 方法捕獲和檢測細胞內 G4 相互作用蛋白質組。
隨後,作者利用 G4PID 探針利用 G4 交互作用蛋白鄰近標記 (PLGPB) 方法捕獲和檢測活細胞內的 G4 交互作用蛋白質組。在包含 578 個蛋白質的三個獨立重複實驗中,使用 G4PID 和 miniTurbo 轉染 HEK293T 細胞,實現了 80% 的同一性。篩選揭示了 149 個與 G4 相互作用的候選蛋白,與現有的 G4 相互作用蛋白資料庫有顯著重疊。此外,基因本體 (GO) 富集分析顯示這些蛋白質與轉錄調控、mRNA 剪接和染色質重塑有顯著關聯,這與 G4 研究的先前發現一致。
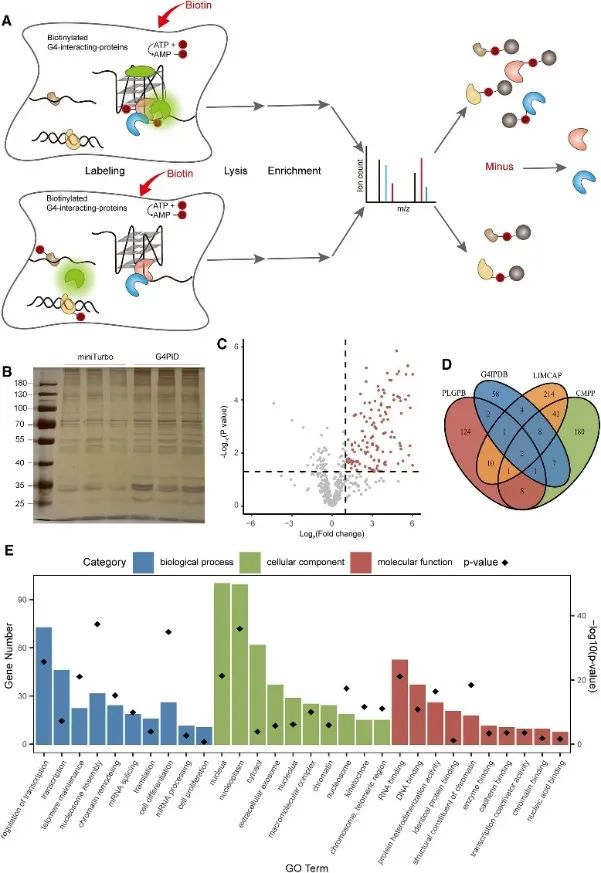
圖3透過PLGPB方法鑑定了與G4相互作用的蛋白質。
4. 在新鑑定的候選者中驗證 G4 結合親和力。
透過 PLGPB 方法,作者發現了一系列涵蓋各種功能類別的候選蛋白,包括常見的端粒相關蛋白、轉錄因子和相對不常見的蛋白質結合蛋白。這表明 PLGPB 方法不僅重申了先前公認的 G4 相互作用蛋白,而且還透過發現跨越不同功能類別的新候選蛋白,顯著拓寬了蛋白質領域。此外,作者驗證了這些候選物與 RNA G4 和 DNA G4 的結合能力,揭示了對 RNA G4 的明顯偏好以及對不同構象的 DNA G4 的親和力的變化。這些發現強調了透過調節 G4 構象來調節蛋白質-G4 相互作用的潛力。
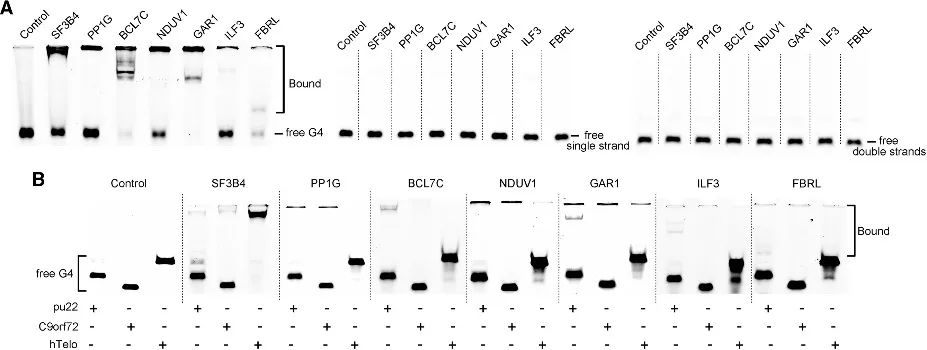
圖 4 候選蛋白與 RNA G4 和 DNA G4 之間的相互作用。
5.確定SF3B4和G4結構的高可信度結合位點。
在研究 G4 結合的體內模式期間,作者發現了 SF3B4 蛋白的重要作用。 SF3B4 因其參與 RNA 剪接而聞名,透過 eCLIP 實驗以及對 rG4-seq 和 DMS-seq 數據的綜合分析,確定了其高可信度結合位點。這些結合位點中大約有一半含有 PQS,主要與非常規 G4 結構相關。此外,作者觀察到 SF3B4 結合位點和 RNA PQS 之間存在密切的空間關係,主要在內含子區域內富集分佈,特別是靠近 3' 剪接位點。這些發現強烈表明 SF3B4 和 G4 結構之間的相互作用可能在選擇性剪接機制中發揮至關重要的作用。
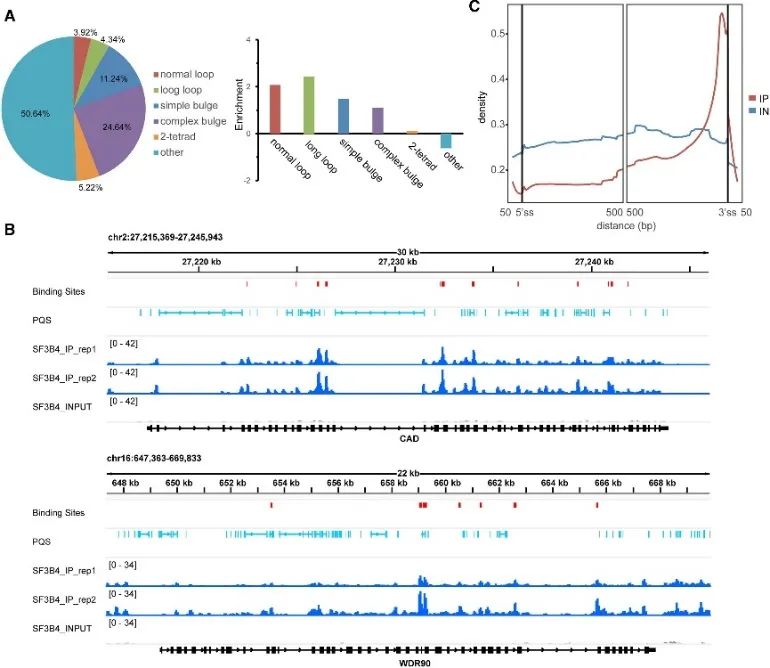
圖 5 使用 eCLIP 技術確定了 SF3B4 在細胞中的 G4 結合偏好。
6. G4 結構調控 SF3B4 介導的選擇性剪接。
作者對 SF3B4 結合位點進行了分析,揭示了其與 G4 結構的關聯,並進一步研究了其在選擇性剪接事件中的調控機制。篩選了涉及可變剪接的常規PQS,選擇兩個基因INPPL1和PPP6R2進行詳細檢查。確認了 INPPL1 和 PPP6R2 內的 G4 結構,稱為 G4-INPPL1 和 G4-PPP6R2,並且 SF3B4 被鑑定為與這些 G4 結構特異性結合。此外,研究表明,添加 G4 配體吡啶他汀 (PDS) 會減少 SF3B4 與 G4 結構的結合,從而促進 INPPL1 和 PPP6R2 mRNA 剪接期間的外顯子包含事件。這些發現表明 G4 結構在 SF3B4 介導的選擇性剪接中的潛在重要性。
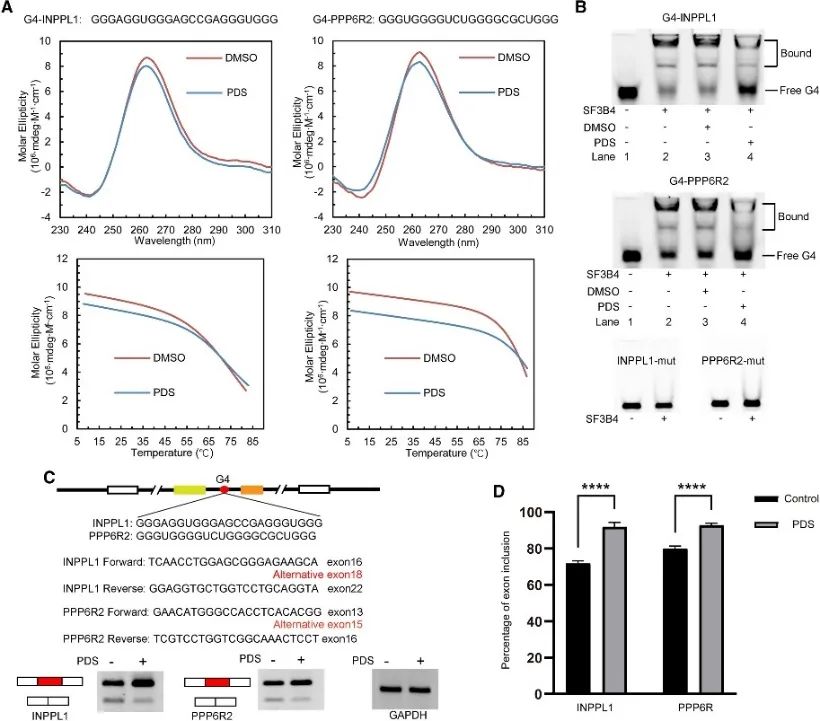
圖6 SF3B4結合G4結構並影響mRNA的選擇性剪接。
總之,本研究引入了一個包含 G4PID 探針和 PLGPB 策略的有效工具包,揭示了細胞內 G4 和蛋白質之間的相互作用如何影響基因表達,特別是影響選擇性剪接的關鍵過程。這些發現加深了我們對G4在細胞生物學過程中的調控機制的理解,並為進一步探索G4相關疾病的治療策略鋪平了道路。

