ABPP 分析揭示了衣康酸透過蛋白質-代謝物相互作用的新抗發炎機制
衣康酸是一種對發炎和免疫調節至關重要的內源性代謝物,ChomiX Biotech 團隊在一篇聯合論文中闡明了其作用。該研究創新性地利用ABPP技術揭示衣康酸修飾關鍵糖解酶上半胱胺酸殘基的S-糖基化,進而影響細胞代謝。研究人員繪製了蛋白質-衣康酸相互作用圖譜,發現衣康酸直接結合併調節糖解途徑中的多種酶,影響其速率和方向。這項研究增進了我們對疾病相關發炎期間代謝控制機制的了解,並證明了 ABPP 在探索小分子如何調節蛋白質功能方面的優勢。作為化學蛋白質體學領域的領導者,Corolus BioScience 提供全面的解決方案,包括探針設計、樣本處理、高通量篩選和數據分析,幫助客戶發現類似的代謝調節機制。
1. 以 1-OH-Az 探針檢測衣康酸修飾
在這項研究中,作者採用先進的分析技術來研究衣康酸靶向半胱氨酸殘基。他們最初透過凝膠電泳評估探針 1-OH-Az,並使用 IA-alkyne 進行競爭性實驗。質譜驗證證實,1-OH-Az 選擇性地標記半胱氨酸位點,其中 87% 的新鑑定蛋白質之前在 DrugBank 中未記錄為配體結合蛋白。鑑於這些蛋白質的不同功能和疾病相關性,1-OH-Az 探針可用於識別活性半胱氨酸作為新型療法的潛在藥物標靶。
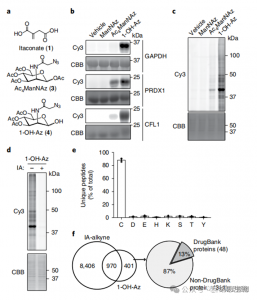
圖 1:1-OH-Az 作為一種高效、獨特的半胱氨酸分析探針,用於檢測衣康酸修飾
2. 使用定量蛋白質體學技術鑑定衣康酸修飾位點
研究人員進行了 isoTOP-ABPP 實驗,使用 1-OH-Az 探針對衣康酸修飾的半胱氨酸殘基進行定量。裂解物預處理後,利用同位素標記的接頭輔助定量蛋白質體學來分析不同濃度的衣康酸的影響,以確定其特定標靶。還使用兩種濃度的 IA-炔進行了比較實驗,雖然顯示出更廣泛的活性和覆蓋範圍,但僅識別了 65 和 50 個有效競爭位點。值得注意的是,1-OH-Az 在共同定量的半胱氨酸中表現出顯著更高的競爭優勢。
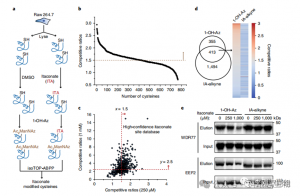
圖 2:利用 1-OH-Az 的競爭性 isoTOP-ABPP 對衣康酸修飾的半胱胺酸進行化學蛋白質體學分析
3. 衣康酸修飾並抑制關鍵的糖解酶
質譜分析表明,衣康酸修飾三種關鍵的糖解酶:ALDOA、GAPDH 和 LDHA。在 LPS 刺激的 Raw264.7 細胞中證實了 ALDOA 的 Cys73 和 Cys339 上的內源性衣康酸修飾。由於它們的接近性,作者推測這種修飾可能會影響醛縮酶活性。事實上,使用 1 mM 衣康酸處理會導致 ALDOA 酶活性降低,但不會影響蛋白質表現。此外,isoTOP-ABPP 分析表明,LDHA 上的 Cys84 和 GAPDH 上的 Cys245 也是衣康酸修飾的目標。

圖 3:衣康酸可以改變並損害 ALDOA 功能
4.衣康酸主要透過靶向ALDOA來抑製糖解
為了評估ITAC 在發炎巨噬細胞糖解作用中的調節作用,作者監測了LPS 刺激前後Raw264.7 細胞的葡萄糖消耗和乳酸產生,證明ITAC 顯著降低了這兩項指標,顯示糖解功能受到抑制。為了驗證 ITAC 對 ALDOA 的影響以及隨後對糖解作用的抑制,他們使用 RNAi 敲低內源性 ALDOA,並在 Raw264.7 細胞中過度表現 WT 或雙突變 (C73S/C339S) ALDOA。正如預期的那樣,ALDOA 的敲低導致葡萄糖消耗和乳酸產生減少,從而使細胞對 ITAC 處理不敏感。重新引入 WT 或突變體 ALDOA 可恢復未處理細胞的代謝量;然而,與 WT 相比,過度表現突變體 ALDOA 的細胞對糖解抑制的敏感性降低。醛縮酶活性的酵素法測定與糖解作用狀態一致。
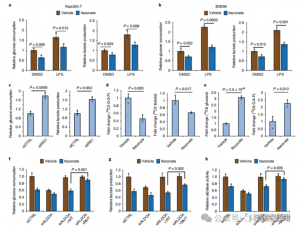
圖 4:衣康酸透過修改 ALDOA 改變糖解途徑
5. 抑制 ALDOA 有助於抗發炎反應
這些發現揭示了 ITAC 透過修飾 ALDOA 上的半胱氨酸殘基 Cys73 和 Cys339 來抑製糖解途徑活性。作者進一步從已知的富馬酸二甲酯透過半胱氨酸修飾 GAPDH 和糖酵解抑制的抗發炎作用推斷,ITAC 可能類似地反饋幹擾糖解作用以發揮抗發炎作用。 ALDOA 的敲低顯著減少了 LPS 刺激後 IL-1β 的分泌,顯示其透過糖解作用參與調節發炎。透過補充丙酮酸部分逆轉 ALDOA 敲低的抗發炎作用顯示 LDHA 在發炎反應中的作用有限。
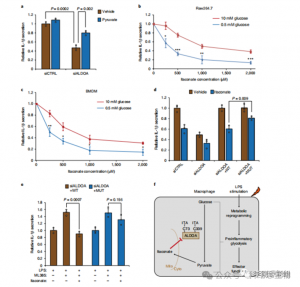
圖 5:衣康酸的抗發炎作用是透過抑制 ALDOA 介導的,從而破壞糖酵解
總之,本文有效地利用基於S-糖基化的半胱氨酸分析技術和ABPP方法建構了衣康酸和相關蛋白質之間的相互作用網絡。它令人信服地證明,衣康酸透過特異性修飾蛋白質上的半胱氨酸殘基來控製糖解途徑,從而充當關鍵的代謝調節劑。這項研究不僅闡明了衣康酸作為新型代謝調節劑的作用機制,也為小代謝物如何與蛋白質相互作用以調節核心代謝途徑提供了有力的證據。
除了 ABPP 之外,研究小分子代謝物與蛋白質之間相互作用的其他方法包括但不限於:
1. 親和力富集(下拉)該技術將天然化合物轉化為生物素化探針,與細胞裂解物一起孵育,然後透過鏈黴親和素介導的富集和分離與生物素探針結合的蛋白質標靶。
2.有限蛋白水解質譜 (LiP-MS)是一種基於蛋白質親和力的標靶發現技術。當特定配體(例如藥物或小分子)與特定蛋白質結合時,它們會引起構象變化或空間位阻,從而導致與未結合蛋白質相比不同的切割位點。透過使用質譜檢測這些差異,該方法可以識別細胞內的藥物-蛋白質相互作用並確定藥物的分子標靶。
3.細胞熱位移測定 (CETSA)最初開發是為了幫助抗癌藥物標靶研究,是最早廣泛使用的用於研究完整細胞中藥物標靶參與的無標記方法之一。 CETSA 主要依賴這樣的原理:化合物與目標蛋白結合後會增加其熱穩定性。在不同溫度梯度下將樣品與化合物和相應對照一起孵育後,與配體結合的蛋白質在加熱後保持折疊且相對穩定,而未結合的蛋白質由於變性而展開並沉澱。隨後透過免疫印跡或基於質譜的方法根據熔解曲線對可溶性蛋白質的熱穩定性進行分析,證實了化合物與細胞內蛋白質之間的相互作用。
4. 親和層析涉及將目標代謝物與固相基質結合以捕獲與其相互作用的蛋白質複合物。然後使用質譜等技術鑑定捕獲的蛋白質。
5.表面等離子共振 (SPR)用於即時、無標記測量與小分子和蛋白質之間相互作用相關的動力學參數。
6. 蛋白質晶體學闡明與小分子配體複合的蛋白質的三維結構,提供對結合位點和作用機制的直觀了解。透過解析這些結構,研究人員可以直接視覺化小分子如何與其蛋白質標靶相互作用。

