ABPP 分析揭示了衣康酸通过蛋白质-代谢物相互作用的新抗炎机制
衣康酸是一种对炎症和免疫调节至关重要的内源性代谢物,ChomiX Biotech 团队在一篇联合论文中阐明了其作用。该研究创新性地利用ABPP技术揭示衣康酸修饰关键糖酵解酶上半胱氨酸残基的S-糖基化,从而影响细胞代谢。研究人员绘制了蛋白质-衣康酸相互作用图谱,发现衣康酸直接结合并调节糖酵解途径中的多种酶,影响其速率和方向。这项研究增进了我们对疾病相关炎症期间代谢控制机制的了解,并证明了 ABPP 在探索小分子如何调节蛋白质功能方面的优势。作为化学蛋白质组学领域的领导者,Corolus BioScience 提供全面的解决方案,包括探针设计、样品处理、高通量筛选和数据分析,帮助客户发现类似的代谢调节机制。
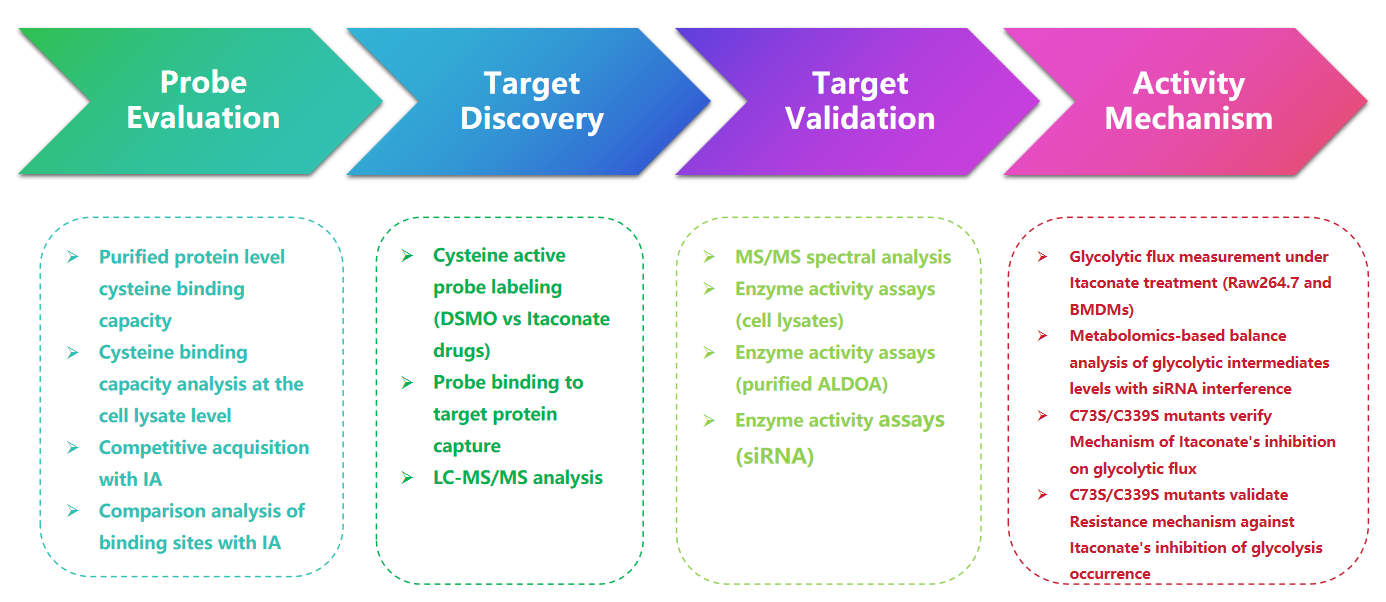
1. 用 1-OH-Az 探针检测衣康酸修饰
在这项研究中,作者采用先进的分析技术来研究衣康酸靶向半胱氨酸残基。他们最初通过凝胶电泳评估探针 1-OH-Az,并使用 IA-alkyne 进行竞争性实验。质谱验证证实,1-OH-Az 选择性标记半胱氨酸位点,其中 87% 的新鉴定蛋白质之前在 DrugBank 中未记录为配体结合蛋白。鉴于这些蛋白质的不同功能和疾病相关性,1-OH-Az 探针可用于识别活性半胱氨酸作为新型疗法的潜在药物靶点。
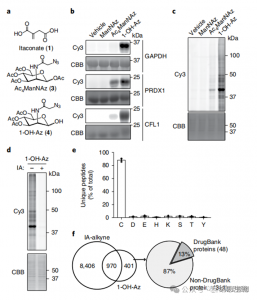
图 1:1-OH-Az 作为一种高效、独特的半胱氨酸分析探针,用于检测衣康酸修饰
2. 使用定量蛋白质组学技术鉴定衣康酸修饰位点
研究人员进行了 isoTOP-ABPP 实验,使用 1-OH-Az 探针对衣康酸修饰的半胱氨酸残基进行定量。裂解物预处理后,利用同位素标记的接头辅助定量蛋白质组学来分析不同浓度的衣康酸的影响,以确定其特定靶标。还使用两种浓度的 IA-炔进行了比较实验,虽然显示出更广泛的活性和覆盖范围,但仅识别了 65 和 50 个有效竞争位点。值得注意的是,1-OH-Az 在共同定量的半胱氨酸中表现出显着更高的竞争优势。
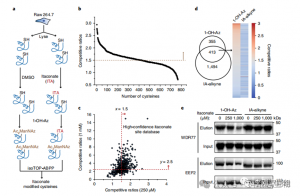
图 2:利用具有 1-OH-Az 的竞争性 isoTOP-ABPP 对衣康酸修饰的半胱氨酸进行化学蛋白质组学分析
3. 衣康酸修饰并抑制关键的糖酵解酶
质谱分析表明,衣康酸修饰三种关键的糖酵解酶:ALDOA、GAPDH 和 LDHA。在 LPS 刺激的 Raw264.7 细胞中证实了 ALDOA 的 Cys73 和 Cys339 上的内源衣康酸修饰。由于它们的接近性,作者推测这种修饰可能会影响醛缩酶活性。事实上,用 1 mM 衣康酸处理会导致 ALDOA 酶活性降低,但不会影响蛋白质表达。此外,isoTOP-ABPP 分析表明,LDHA 上的 Cys84 和 GAPDH 上的 Cys245 也是衣康酸修饰的目标。

图 3:衣康酸可以改变和损害 ALDOA 功能
4.衣康酸主要通过靶向ALDOA来抑制糖酵解
为了评估 ITAC 在炎症巨噬细胞糖酵解中的调节作用,作者监测了 LPS 刺激前后 Raw264.7 细胞的葡萄糖消耗和乳酸产生,证明 ITAC 显着降低了这两项指标,表明糖酵解功能受到抑制。为了验证 ITAC 对 ALDOA 的影响以及随后对糖酵解的抑制,他们使用 RNAi 敲低内源性 ALDOA,并在 Raw264.7 细胞中过表达 WT 或双突变 (C73S/C339S) ALDOA。正如预期的那样,ALDOA 的敲低导致葡萄糖消耗和乳酸产生减少,从而使细胞对 ITAC 处理不敏感。重新引入 WT 或突变体 ALDOA 可恢复未处理细胞的代谢水平;然而,与 WT 相比,过表达突变体 ALDOA 的细胞对糖酵解抑制的敏感性降低。醛缩酶活性的酶法测定与糖酵解状态一致。
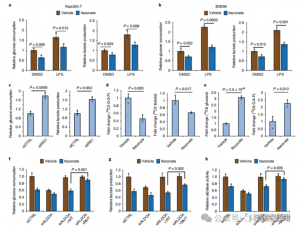
图 4:衣康酸通过修改 ALDOA 改变糖酵解途径
5. 抑制 ALDOA 有助于抗炎反应
这些发现揭示了 ITAC 通过修饰 ALDOA 上的半胱氨酸残基 Cys73 和 Cys339 来抑制糖酵解途径活性。作者进一步从已知的富马酸二甲酯通过半胱氨酸修饰 GAPDH 和糖酵解抑制的抗炎作用推断,ITAC 可能类似地反馈干扰糖酵解以发挥抗炎作用。 ALDOA 的敲低显着减少了 LPS 刺激后 IL-1β 的分泌,表明其通过糖酵解参与调节炎症。通过补充丙酮酸部分逆转 ALDOA 敲低的抗炎作用表明 LDHA 在炎症反应中的作用有限。
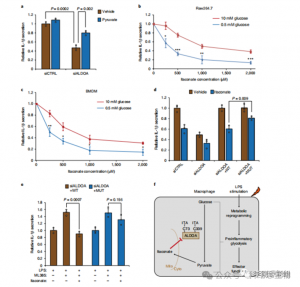
图 5:衣康酸的抗炎作用是通过抑制 ALDOA 介导的,从而破坏糖酵解
总之,本文有效地利用基于S-糖基化的半胱氨酸分析技术和ABPP方法构建了衣康酸和相关蛋白质之间的相互作用网络。它令人信服地证明,衣康酸通过特异性修饰蛋白质上的半胱氨酸残基来控制糖酵解途径,从而充当关键的代谢调节剂。这项研究不仅阐明了衣康酸作为新型代谢调节剂的作用机制,而且还为小代谢物如何与蛋白质相互作用以调节核心代谢途径提供了有力的证据。
除了 ABPP 之外,研究小分子代谢物与蛋白质之间相互作用的其他方法包括但不限于:
1. 亲和力富集(下拉)该技术将天然化合物转化为生物素化探针,与细胞裂解物一起孵育,然后通过链霉亲和素介导的富集和分离与生物素探针结合的蛋白质靶标。
2.有限蛋白水解质谱 (LiP-MS)是一种基于蛋白质亲和力的靶标发现技术。当特定配体(例如药物或小分子)与特定蛋白质结合时,它们会引起构象变化或空间位阻,从而导致与未结合蛋白质相比不同的切割位点。通过使用质谱检测这些差异,该方法可以识别细胞内的药物-蛋白质相互作用并确定药物的分子靶点。
3.细胞热位移测定 (CETSA)最初开发是为了帮助抗癌药物靶点研究,是最早广泛使用的用于研究完整细胞中药物靶点参与的无标记方法之一。 CETSA 主要依赖于这样的原理:化合物与靶蛋白结合后会增加其热稳定性。在不同温度梯度下将样品与化合物和相应对照一起孵育后,与配体结合的蛋白质在加热后保持折叠和相对稳定,而未结合的蛋白质由于变性而展开并沉淀。随后通过免疫印迹或基于质谱的方法根据熔解曲线对可溶性蛋白质的热稳定性进行分析,证实了化合物与细胞内蛋白质之间的相互作用。
4. 亲和层析涉及将目标代谢物与固相基质结合以捕获与其相互作用的蛋白质复合物。然后使用质谱等技术鉴定捕获的蛋白质。
5.表面等离子共振 (SPR)用于实时、无标记测量与小分子和蛋白质之间相互作用相关的动力学参数。
6. 蛋白质晶体学阐明与小分子配体复合的蛋白质的三维结构,提供对结合位点和作用机制的直观了解。通过解析这些结构,研究人员可以直接可视化小分子如何与其蛋白质靶标相互作用。

