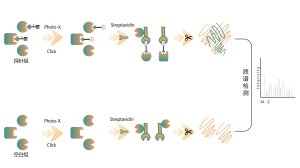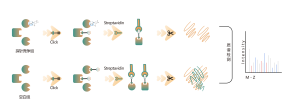Produits
Modifications post-traductionnelles de la sérine/thréonine
Les modifications post-traductionnelles (PTM) de la sérine et de la thréonine font référence aux modifications chimiques que les protéines subissent après la synthèse, la phosphorylation et la glycosylation étant les formes de modification les plus courantes. Les PTM sur les résidus sérine et thréonine incluent principalement la phosphorylation et la O-glycosylation. Après modification, ces résidus d'acides aminés peuvent modifier considérablement l'activité, la stabilité et les capacités d'interaction de la protéine, jouant ainsi un rôle crucial dans la transduction de la signalisation cellulaire, la régulation métabolique et d'autres processus biologiques clés. Des études approfondies de ces modifications aident à révéler les mécanismes moléculaires à l’origine des activités vitales et pourraient fournir de nouvelles cibles pour le traitement des maladies. Par conséquent, les PTM à sérine et thréonine revêtent une importance indispensable à la fois dans la recherche biologique fondamentale et dans les applications cliniques.
Chomix possède une technologie avancée de spectrométrie de masse capable d'analyser directement et précisément divers types de modifications post-traductionnelles de protéines et leurs sites spécifiques. En combinant intelligemment les techniques d’enrichissement par séparation et de marquage isotopique, des analyses qualitatives et quantitatives à grande échelle et à haut débit de diverses modifications peuvent être réalisées, fournissant ainsi un support technique solide pour une recherche approfondie sur les modifications post-traductionnelles des protéines.
Plateau Technique (O-glycosylation)
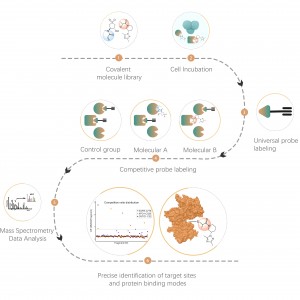
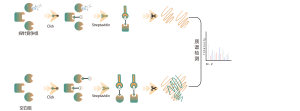
La glycosylation liée à l'O est un processus biochimique qui transfère les chaînes de sucre aux atomes d'oxygène des résidus sérine et thréonine dans les chaînes peptidiques. À l’aide des réactifs UDP-GalNAz et Y289L GalT1, ces agents peuvent marquer les molécules de sucre sur les sites de glycosylation avec un groupe -N3. Les étapes ultérieures impliquant la chimie du clic, la digestion enzymatique, l’enrichissement et la spectrométrie de masse à haute résolution permettent l’identification précise des sites de O-glycosylation, révélant ainsi le rôle crucial de cette modification post-traductionnelle dans les organismes.

Nos avantages
1. Expertise professionnelle : Forts d’une vaste expérience et de publications dans des revues de premier plan, nous proposons des services sur mesure pour des résultats optimaux.
2. Gestion rigoureuse de la qualité : nos systèmes de qualité matures adhèrent aux normes ISO9001, garantissant des rapports fiables.
3. Service complet : De la conception de la sonde à l'analyse bioinformatique, nous fournissons une consultation tout-en-un jusqu'à la livraison, avec des mises à jour ponctuelles des progrès.
4. Équipement avancé : Équipés de spectromètres de masse de pointe comme le Thermo Fisher Orbitrap Exploris 480 et le Bruker timsTOF, nous soutenons la recherche révolutionnaire.
Notre service
| Projet | Modifications post-traductionnelles de la sérine/thréonine basées sur la spectrométrie de masse à haute résolution |
| Échantillon | Lysat, cellules vivantes, échantillons de tissus |
| Plateforme matérielle | VanquishNeo UPLC couplé au spectromètre de masse Orbitrap Exploris 480 (Thermo Fisher Scientific) ; EASY-nLC1200 UPLC couplé au spectromètre de masse Q Exactive HF-X (Thermo Fisher Scientific) |
| Durée du projet | 4-8 semaines |
| Livrables | Rapport de projet (y compris des images de gel, des informations sur le site, etc.) |
| Prix | Cliquez pour consulter |
Étude de cas
Objectif du projet : L'objectif de ce projet est de mener une analyse protéomique chimique approfondie de la modification post-traductionnelle de l'O-GlcNAcylation à l'aide de la technologie de spectrométrie de masse.
Solution : Nous utilisons une approche combinée de marquage métabolique et de spectrométrie de masse pour effectuer une analyse qualitative précise et complète des sites de O-glycosylation. Dans le processus expérimental, nous déterminons d’abord la quantité d’enzyme Y289L GalT1 à l’aide de la technologie du gel de fluorescence, suivie d’une analyse spectrométrique de masse dans des conditions expérimentales rigoureusement définies. Grâce à deux séries d’expériences répétées, un total de 36 sites de glycosylation fiables ont été identifiés. Un exemple d'un spectre MS2 typique est présenté.